癌細胞以冬眠方式躲過化療
時間回到三年前,加拿大瑪格麗特公主癌癥中心的Catherine O'Brien博士聽了一場學術報告,內容與她研究的消化道癌癥似乎并沒有什么直接關系,講的是小鼠的胚胎發育,有一種被稱為“滯育”(diapause)的奇妙現象。事實上,科學家們發現,包括小鼠在內的100多種哺乳動物可以在高溫、寒冷或缺乏食物等不利條件下,讓胚胎暫停發育,等到環境條件轉好后,再讓妊娠繼續。
人類似乎失去了這種胚胎滯育的能力,但O'Brien博士靈光一閃:“癌細胞會不會是利用這種生存機制在惡劣的化療環境中活下來?”為了檢驗這種可能性,她與作報告的科學家Miguel Ramalho-Santos博士取得聯系,并展開了合作。
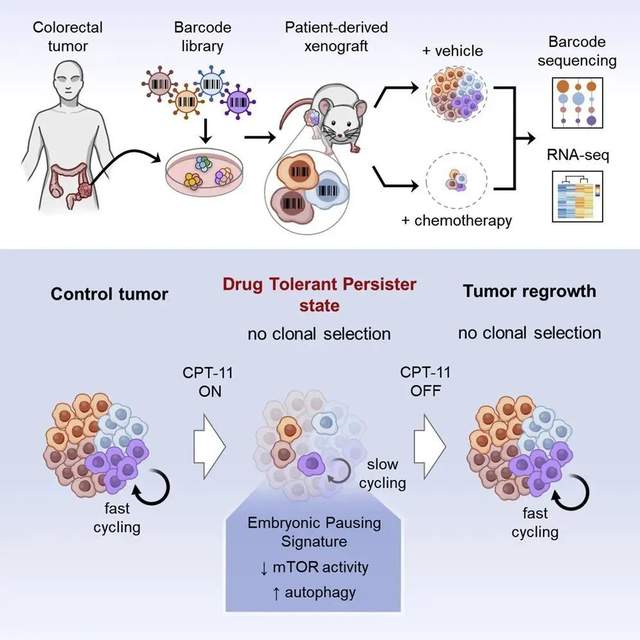
研究人員將一些來自結腸癌患者的腫瘤細胞放在培養皿中培養,并用化療藥物進行處理。原本快速增殖的癌細胞分裂速度減慢,代謝大大降低。利用先進的測序技術,檢查這些癌細胞的基因表達譜發現,它們與滯育小鼠胚胎有著驚人的相似性。結合測序結果和數學模型的分析還顯示,能夠進入類似滯育狀態的癌細胞并非只是具有特定基因表達特性的一小群細胞,而是所有癌細胞。
“腫瘤就像一個完整的生物體,能夠進入緩慢分裂的狀態,節省能量,提高存活能力。”O'Brien博士描述道。你可以把這些癌細胞想象成進入冬眠的熊,另一位研究作者Aaron Schimmer補充說。冬眠的熊會醒來,在停止使用化療藥物處理后,癌細胞們也會再次全速增殖。
那么,有辦法不讓冬眠的熊醒來嗎?進一步探索背后的機制,研究人員發現,與滯育的胚胎相似,處于緩慢分裂狀態的癌細胞,需要激活一種叫作“自噬”(autophagy)的細胞過程。也就是說,它們會循環使用自身的蛋白質或細胞成分,以便在化療導致的惡劣環境中活下去。
順著這個思路,研究人員發現了治療的機會:如果在化療中干擾癌細胞的自噬,是不是就能降低癌細胞的生存能力,避免癌癥的復發?后續實驗證實了這一點。研究人員測試了一種抑制自噬的小分子化合物。而失去自噬功能的癌細胞,終于被化療藥物成功殺死。
發現癌細胞免受鐵死亡新機制
癌癥的特征包括快速的細胞增殖和代謝活動。但這些過程也會導致細胞氧化應激的增加,以及細胞死亡風險的增加。為了規避超速生長帶來的負面后果,癌細胞會刺激減少氧化應激的途徑來避免細胞死亡。在一項新的研究中,來自美國莫菲特癌癥中心的研究人員報告了一種新發現的生化途徑,該途徑可以保護癌細胞免受一種叫做鐵死亡(ferroptosis)的細胞死亡。相關研究結果近期發表在Cell Metabolism期刊上。
鐵死亡是一種特殊類型的細胞死亡,是由細胞內氧化不平衡引起的。鐵死亡會導致細胞膜中的脂質分子發生變化,可以由半胱氨酸饑餓(cysteine starvation,指的是半胱氨酸缺乏)引起。
半胱氨酸是一種氨基酸,是蛋白的組成成分之一,也被身體用于許多重要的生理過程,包括細胞生存、對氧化還原反應的調節和能量轉移。鑒于半胱氨酸在正常過程中起著關鍵作用,對半胱氨酸進行高度調控以防止這種氨基酸的過量或不足。
一些不同類型的癌癥過度表達在半胱氨酸調節中起重要作用的分子。這表明降低半胱氨酸水平可能會對癌癥生長產生負面影響。事實上,已有研究表明,抑制半胱氨酸攝取或讓癌細胞遭受半 胱氨酸饑餓,可以誘導癌細胞經歷細胞死亡。然而,半胱氨酸饑餓刺激的下游過程尚不清楚。在這項新的研究中,這些研究人員進行了一系列的實驗室調查,以了解半胱氨酸被剝奪后哪些分子被激活,以及這會如何影響細胞。
研究人員發現,癌細胞可以激活保護自己免受半胱氨酸饑餓導致的細胞死亡的信號通路。當他們讓非小細胞肺癌細胞經歷半胱氨酸饑餓時,這些癌細胞開始發生鐵死亡。然而,半胱氨酸饑餓也導致一種名為γ-谷氨酰肽(γ-glutamyl-peptide)的小分子的意外積累,這種小分子可以保護癌細胞免受鐵死亡。他們發現γ-谷氨酰肽是通過蛋白GCLC的活性合成的。在正常情況 下,GCLC參與了利用半胱氨酸和谷氨酸合成抗氧化劑谷胱甘肽的第一步。然而,這種新發現的GCLC活性發生在半胱氨酸缺乏的情況下,并且對限制谷氨酸積累和這種氧化劑產生很重要。
研究人員進一步分析了控制GCLC介導的肽合成的信號機制,發現GCLC受到蛋白NRF2的調控。他們發現,在正常條件下,NRF2調節GCLC以產生谷胱甘肽,但在半胱氨酸饑餓的條件下,NRF2調節GGLC產生以γ-谷氨酰肽。
論文通訊作者、莫菲特癌癥中心癌癥生理學系助理成員Gina DeNicola博士說,“眾所周知,NRF2在阻止細胞氧化中起著重要作用,并且在肺癌中經常失調。NRF2阻止鐵死亡的能力對癌癥有重 要意義,特別是肺癌。在肺癌中,通常通過KEAP1和NRF2發生突變來激活NRF2。”

幫助免疫系統識別腫瘤細胞
日前,四川大學生物治療國家重點實驗室鞏長旸研究員團隊在材料領域的國際一流學術雜志《Advanced Functional Materials》(《先進功能材料》)發表論文,其團隊在全球首次通過胞內阻斷方式完成腫瘤細胞CD47和PD-L1雙免疫檢查點的徹底阻斷,通過“靶向遞送”的方式,達到精準殺死腫瘤細胞而不傷及正常細胞的目的。更重要的是,極大地提高了對腫瘤細胞的殺傷力。
目前,這項研究已經完成小鼠實驗,并取得良好效果,預計5年左右能夠進入臨床試驗,10年左右有望進入臨床運用。
據鞏長旸介紹,其團隊開展的這項研究,核心是調動人體自身免疫系統,去發揮殺死腫瘤細胞的作用。該研究是基于2018年諾貝爾生理學或醫學獎獲得者發現的“免疫檢查點療法”。也就是說,諾獎得主發現了可以編輯基因組的工具,鞏長旸團隊利用這個工具實現了編輯腫瘤細胞內的兩個免疫檢查點,達到了更好的抗腫瘤效果。
舉個例子:免疫系統相當于是“警察”,腫瘤細胞相當于是“壞人”,當正常細胞通過時,免疫系統予以識別,對上了“暗號”就認為是“自己人”,放行;對不上“暗號”,就識別為“壞人”,隨即啟動機體免疫反應,正常細胞對腫瘤細胞發起“圍攻”。也就是說,免疫系統在保護正常細胞不被自身攻擊的同時,還有一個作用就是要抓捕腫瘤細胞,并將其殺滅。
然而,腫瘤細胞是一類非常“狡猾”的細胞,這些“壞人”在長期的“戰斗”中也積累了豐富的經驗,極其善于偽裝,它會想辦法制作不同的“假證件”,即免疫檢查點,以逃避免疫系統的檢查。當“警察”看到偽裝的腫瘤細胞時,由于缺乏足夠多的識別手段,于是將其放走,給腫瘤細胞提供了生存的機會。
為了幫助免疫系統提高識別能力,鞏長旸和他的團隊目前研發了一種具有模仿天然病毒結構,并可以識別腫瘤細胞的基因藥物。這種藥物能夠精準達到腫瘤細胞,摧毀其迷惑“警察”的“假證件”,讓免疫系統自主殺死腫瘤細胞,而不傷及其余正常細胞。其抗癌原理,與天然抗腫瘤藥用真菌白樺茸通過調節免疫系統來達到抑制癌細胞增殖,誘發癌細胞凋亡的機制有著類似之處。

特別聲明:本文來源為騰訊網、生物谷、四川在線等媒體;本文圖片來自網絡,如有侵權請聯系刪除。